|
Tổ thông tin thuốc và theo dõi phản ứng có hại của thuốc (ADR) (06/2022)
Nguồn: http://magazine.canhgiacduoc.org.vn/Magazine/Details/234
I. DOMPERIDON: CẬP NHẬT GIỚI HẠN CHỈ ĐỊNH
Nguyễn Thị Tuyến
Domperidon là thuốc đối kháng dopamin, được chỉ định điều trị triệu chứng nôn và buồn nôn. Năm 2014, cuộc rà soát về độ an toàn tại châu Âu đã đưa ra giới hạn chỉ định mới sau khi cơ quan quản lý liên tục nhận được các báo cáo phản ứng có hại trên tim liên quan đến thuốc này [1]. Vào thời điểm đó, chưa có đủ dữ liệu chứng minh hiệu quả giảm triệu chứng nôn và buồn nôn của thuốc trên trẻ em. Do đó, cơ quan quản lý đã yêu cầu thực hiện thêm các nghiên cứu cung cấp dữ liệu bổ sung về hiệu quả của thuốc trên bệnh nhân nhi. Một nghiên cứu tiến cứu, đa trung tâm, mù đôi, ngẫu nhiên, có đối chứng với giả dược đã được thực hiện để đánh giá hiệu quả và độ an toàn của domperidon trên bệnh nhi mắc viêm dạ dày - ruột cấp [2]. 292 trẻ trong độ tuổi từ 6 tháng đến 12 tuổi (trung vị 7 tuổi) được đưa vào nghiên cứu. Ngoài biện pháp điều trị bù nước bằng đường uống (oral rehydration treatment - ORT), bệnh nhi được ngẫu nhiên uống hỗn dịch domperidon liều 0,25 mg/kg (liều tối đa 30 mg/ngày), hoặc dùng giả dược, 3 lần/ngày, dùng trong 7 ngày. Nghiên cứu này không chứng minh được việc sử dụng hỗn dịch domperidon và ORT hiệu quả hơn sử dụng giả dược và ORT để giảm triệu chứng nôn trong 48 giờ đầu. Nghiên cứu không ghi nhận vấn đề an toàn mới nào phát sinh liên quan đến thuốc [2].
Tại Pháp, việc sử dụng domperidon trong nhi khoa đã không còn được bảo hiểm chi trả do thiếu bằng chứng về hiệu quả điều trị từ năm 2017. Ngày 28/6/2019, ANSM đã có thông báo chính thức quyết định giới hạn sử dụng domperidon, theo đó, các thuốc có chứa domperidon chỉ được sử dụng ở người lớn và thanh thiếu niên từ 12 tuổi trở lên có cân nặng từ 35 kg trở lên. Domperidon không còn được chỉ định cho trẻ em dưới 12 tuổi và cân nặng dưới 35 kg [3].
Tương tự Pháp, tờ hướng dẫn sử dụng thuốc tại Anh cũng mới được cập nhật để loại bỏ chỉ định cho trẻ em dưới 12 tuổi [4], [5]. Tại nước này, domperidon cũng được sử dụng cho trẻ em ngoài chỉ định được cấp phép trong một số trường hợp cần tác dụng trên nhu động đường tiêu hóa ngoài điều trị nôn và buồn nôn. Cơ quan Quản lý Dược phẩm và Sản phẩm Y tế Anh (MHRA) khuyến cáo trong trường hợp cụ thể, nếu bác sĩ điều trị xem xét việc sử dụng domperidon cho trẻ dưới 12 tuổi là hợp lý, người bệnh hoặc bố mẹ/người chăm sóc cần được thông báo đầy đủ về lợi ích và nguy cơ của các biện pháp điều trị khác nhau [6].
Để đảm bảo an toàn cho người bệnh, MHRA cũng nhắc lại với cán bộ y tế về việc sử dụng domperidon theo tờ hướng dẫn sử dụng. Năm 2014, cuộc rà soát độ an toàn của thuốc tại châu Âu đã khẳng định nguy cơ gặp phản ứng có hại nghiêm trọng trên tim liên quan đến domperidon, bao gồm kéo dài khoảng QT, xoắn đỉnh, rối loạn nhịp thất nghiêm trọng và đột tử do tim. Cuộc rà soát kết luận cần bổ sung các biện pháp giảm thiểu nguy cơ để cải thiện cân bằng lợi ích - nguy cơ và giảm nguy cơ các tác dụng không mong muốn nghiêm trọng trên tim. Một số nghiên cứu gần đây tại các nước châu Âu, trong đó có Anh, chỉ ra rằng một số bác sĩ đã không nắm được các thay đổi trong chỉ định và chống chỉ định được đưa ra từ năm 2014, do đó, cần nhắc lại tuân thủ cảnh báo, thận trọng nhằm sử dụng an toàn các thuốc chứa domperidon [6].
Tại Việt Nam, Cục Quản lý Dược hiện chưa bổ sung thêm cảnh báo liên quan đến sử dụng thuốc trên bệnh nhân nhi dưới 12 tuổi. Dựa trên kết quả rà soát của châu Âu năm 2014, Cục Quản lý Dược trước đó đã có công văn số 9234/QLD-ĐK ngày 25/5/2015 về việc cập nhật thông tin dược lý đối với thuốc chứa domperidon. Trong đó, nhãn thuốc, tờ hướng dẫn sử dụng và/hoặc tờ thông tin cho bệnh nhân được yêu cầu cập nhật, bổ sung nguy cơ gây hại trên tim liên quan đến domperidon [7]. Các thông tin quan trọng cần lưu ý như sau [6], [7]:
Chỉ định
Domperidon được chỉ định để điều trị triệu chứng nôn và buồn nôn
Chống chỉ định
Chống chỉ định domperidon trong các trường hợp sau:
- Bệnh nhân suy gan mức độ trung bình đến nặng.
- Bệnh nhân có tiền sử kéo dài khoảng thời gian dẫn truyền tim (đặc biệt là khoảng QT).
- Bệnh nhân có bệnh lý tim như suy tim sung huyết do làm tăng nguy cơ rối loạn nhịp thất.
- Bệnh nhân rối loạn điện giải rõ rệt (hạ kali máu, tăng kali máu, hạ magnesi máu) do làm tăng nguy cơ rối loạn nhịp thất hoặc loạn nhịp tim.
- Dùng đồng thời với các thuốc kéo dài khoảng QT. Cụ thể:
+ Thuốc chống loạn nhịp tim phân nhóm IA (ví dụ disopyramid, hydroquinidin, quinidin);
+ Thuốc chống loạn nhịp tim nhóm III (ví dụ amiodaron, dofetilid, dronedaron, ibutilid, sotalol);
+ Một số thuốc chống loạn thần (như haloperidol, pimozid, sertindol);
+ Một số thuốc chống trầm cảm (như citalopram, escitalopram);
+ Một số kháng sinh (như erythromycin, levofloxacin, moxifloxacin, spiramycin, …);
+ Một số thuốc chống nấm (như pentamidin);
+ Một số thuốc điều trị sốt rét (đặc biệt là halofantrin, lumefantrin);
+ Một số thuốc dạ dày – ruột (như cisaprid, dolasetron, prucaloprid);
+ Một số thuốc kháng histamin (như mequitazin, mizolastin);
+ Một số thuốc điều trị ung thư (như toremifen, vandetanib, vincamin);
+ Một số thuốc khác (như bepridil, diphemanil, methadon);
+ Apomorphin, trừ khi lợi ích vượt trội nguy cơ và tuân thủ nghiêm ngặt khuyến cáo thận trọng.
- Dùng đồng thời với thuốc có khả năng ức chế CYP3A4 mạnh (không phụ thuộc nguy cơ kéo dài khoảng QT như các thuốc ức chế protease, các thuốc kháng nấm azol tác dụng toàn thân, một số kháng sinh nhóm macrolid (erythromycin, clarithromycin, telithromycin).
- Bệnh nhân quá mẫn với domperidon.
- Bệnh nhân có khối u tuyến yên giải phóng prolactin.
- Các bệnh nhân nhu động dạ dày bị kích thích có thể gặp phản ứng có hại do domperidon (ví dụ, bệnh nhân xuất huyết dạ dày - ruột, tắc ruột hoặc thủng ruột).
Khuyến cáo về liều dùng và thời gian điều trị
- Với bệnh nhân người lớn và trẻ em từ 12 tuổi và có cân nặng từ 35 kg trở lên, liều khuyến cáo tối đa trong 24 giờ là 30 mg (10 mg/lần, tối đa 3 lần/ngày).
- Sử dụng domperidon với liều thấp nhất có hiệu quả trong khoảng thời gian ngắn nhất có thể và thời gian điều trị không nên quá 1 tuần.
- Báo cáo phản ứng có hại nghi ngờ do thuốc cho các Trung tâm Cảnh giác dược.
Cảnh báo và thận trọng
Tác dụng trên tim mạch
Domperidon làm kéo dài khoảng QT trên điện tâm đồ. Trong quá trình giám sát hậu mại, có rất ít báo cáo về kéo dài khoảng QT và xoắn đỉnh liên quan đến sử dụng domperidon. Các báo cáo này có các yếu tố nguy cơ gây nhiễu như rối loạn điện giải hay các thuốc dùng đồng thời.
Các nghiên cứu dịch tễ cho thấy domperidon có thể làm tăng nguy cơ loạn nhịp thất nghiêm trọng hoặc đột tử do tim mạch. Nguy cơ này cao hơn đối với bệnh nhân trên 60 tuổi, bệnh nhân dùng liều hàng ngày lớn hơn 30 mg và bệnh nhân dùng đồng thời thuốc kéo dài khoảng QT hoặc thuốc ức chế CYP3A4.
Sử dụng domperidon với liều thấp nhất có hiệu quả ở người lớn và trẻ am.
Chống chỉ định domperidon cho những bệnh nhân có thời gian dẫn truyền xung động tim kéo dài, đặc biệt là khoảng QT, bệnh nhân có rối loạn điện giải rõ rệt (hạ kali máu, tăng kali máu, hạ magnesi máu) hoặc nhịp tim chậm đã được biết đến là yếu tố làm tăng nguy cơ loạn nhịp tim.
Cần ngừng điều trị với domperidon và trao đổi lại với cán bộ y tế nếu có bất kỳ triệu chứng hay dấu hiệu nào liên quan đến rối loạn nhịp tim.
Khuyến cáo bệnh nhân nhanh chóng báo cáo các triệu chứng trên tim mạch.
Trong khi chờ quyết định của Cục Quản lý Dược, cán bộ y tế có thể cân nhắc các khuyến cáo về domperidon từ các cơ quan quản lý khác trên thế giới để sử dụng domperidon hợp lý, an toàn [3], [6]
Thay đổi chỉ định
- Hiện tại, domperidon chỉ được cấp phép để giảm triệu chứng nôn, buồn nôn ở người lớn và trẻ em từ 12 tuổi và có cân nặng từ 35 kg trở lên.
- Cân nhắc sử dụng các biện pháp điều trị thay thế domperidon ở trẻ dưới 12 tuổi cần giảm triệu chứng nôn và buồn nôn.
Dược thư Quốc gia Anh dành cho Trẻ em (BNFC) khuyến cáo chỉ nên sử dụng các thuốc chống nôn khi đã xác định được nguyên nhân, do việc dùng thuốc có thể làm trì hoãn chẩn đoán, đặc biệt ở trẻ nhỏ [8]. Trong một số trường hợp, việc sử dụng các thuốc này không cần thiết, thậm chí có nguy cơ gây hại khi có thể điều trị nguyên nhân nhân gây nôn, ví dụ nhiễm toan ceton ở bệnh nhân đái tháo đường, quá liều digoxin hoặc thuốc chống động kinh. Nếu người bệnh được kê liệu pháp chống nôn, cần lựa chọn thuốc dựa vào nguyên nhân gây ra triệu chứng này [8]. Trong đó, theo Cơ sở dữ liệu tra cứu thông tin thuốc trực tuyến Uptodate, Micromedex và Dược thư Quốc gia Anh cho trẻ em (BNFC) truy xuất trực tuyến qua cổng thông tin Medicines Complete, có thể sử dụng một số thuốc khác để điều trị nôn và buồn nôn. Tổng hợp chỉ định, liều dùng, cách dùng của các thuốc xin xem trong bảng 1 [9], [10], [11].
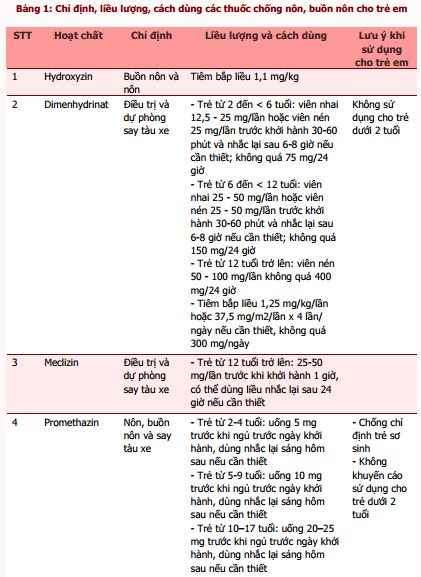 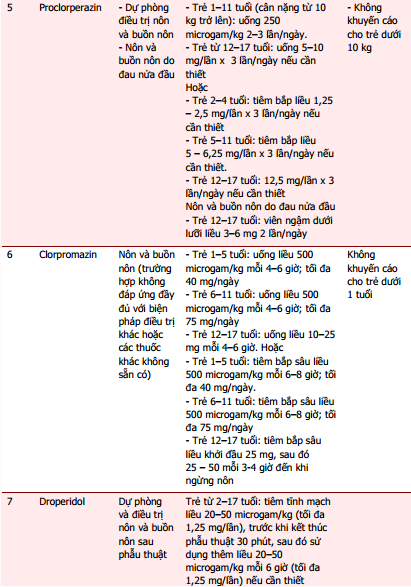  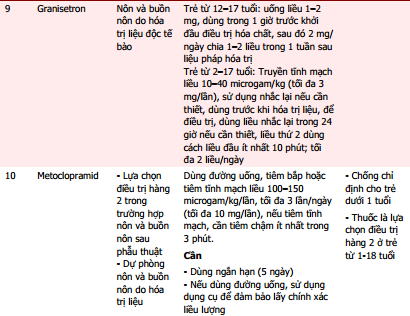
Tài liệu tham khảo
1. EMA (2014), Restrictions on the use of domperidone-containing medicines, dated 01 September 2014.
2. Leitz G, et al. (2019), Safety and Efficacy of Low-dose Domperidone for Treating Nausea and Vomiting Due to Acute Gastroenteritis in Children, J Pediatr Gastroenterol Nutr; 69: 425-30.
3. ANSM (2019), https://eurekasante.vidal.fr/actualites/ 23469-motilium-et-generiques-domperidone-suppression-de-l-indication-chez-l-enfant-de-moins-de-12-ans-et-pesant-moins-de-35-kg.html.
4. EMC (2020), Summary Product Characteristics of Domperidone 10mg Tablets, https://www.medicines.org.uk/emc/product/556/smpc.
5. EMC (2020), Summary of Product Characteristics Motilium 10mg Film-coated Tablets, https://www.medicines.org.uk/emc/product/4177/smpc.
6. MHRA (2019), Domperidone for nausea and vomiting: lack of efficacy in children; reminder of contraindications in adults and adolescents, Drug Safety Update, Volume 13 Issue 5 December 2019.
7. Cục Quản lý Dược Việt Nam (2015), Công văn số 9234/QLD-ĐK ngày 25/5/2015 về việc cập nhật thông tin dược lý đối với thuốc chứa domperidon.
8. BNF for Children (2018-2019), Chapter 4. Nervous system, Nausea and labyrinth disorders, 259-260.
9. Carlo Di Lorenzo, Approach to the infant or child with nausea and vomiting, accessed online via http://www.Uptodate.com, accessed on 28th, March, 2020
10. BNFC. Monograph Prommethazin, Prochlorperazin, Chlorpromazin, Metoclopramid, Granisetron, Odansetron: The Complete Drug Reference: accessed online via http://www.medicinescomplete.com, accessed on 31th, March, 2020.
11. Truven Health Analytics. Micromedex 2.0. Monograph Hydroxyzin, Dimenhydrinat, Meclizin, Droperidol. Accessed online via http://micromedexsolutions.com, accessed on 31th, March, 2020.
II. BÁO CÁO ADR TẠI TTYT HUYỆN GÒ QUAO THÁNG 05/2022
Trong tháng 5/2022 không ghi nhận trường hợp nào xảy ra phản ứng có hại của thuốc (ADR).
III. THU HỒI GIẤY ĐĂNG KÝ LƯU HÀNH THUỐC, THU HỒI THUỐC LƯU HÀNH TRÊN THỊ TRƯỜNG THÁNG 06:
1. Căn cứ công văn số 1922/SYT-NVYD của Sở Y tế Kiên Giang ngày 9 tháng 6 năm 2022 về việc mẫu Voltarén 75 mg giả.
- Tên thuốc: Voltarén 75 mg solución inyectable. Số lô: 81111. Ngày hết hạn: 12.2023.
- Nhà sản xuất in trên bao bì: Novartis Farmacécutica, S.A. Gran Via de les Corrta Catalenes, 76408013 Barcelona.
- Ngôn ngữ trình bày trên vỏ hộp và ống tiêm chỉ có tiếng Tây Ban Nha. Không có các thông tin tiếng Việt in hoặc dán trên bao bì.
- Kích thước hộp: ngang 12,0cm x dọc 10,5cm; Không có Số đăng ký lưu hành, có mã vạch.
2. Căn cứ công văn số 1924/SYT-NVYD của Sở Y tế Kiên Giang ngày 9 tháng 6 năm 2022 về việc thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam đối với 05 thuốc được cấp giấy đăng ký lưu hành.
- Thuốc: Pompezo 40mg (Esomeprazol 40mg), dạng bào chế: viên nang cứng, số đăng ký: VN-22822-21;
- Thuốc: Pompezo 20mg (Esomeprazol 20mg), dạng bào chế: viên nang cứng, số đăng ký: VN-22821-21;
- Thuốc: Choludexan 300mg (Acid ursodeoxycholic 300mg), dạng bào chế: Viên nang cứng, số đăng ký: VN-22820-21;
- Thuốc: Etacid 0,05% (Mỗi liều xịt chứa: Mometason furoat 50mcg), dạng bào chế: Hỗn dịch xịt mũi, số đăng ký: VN-22725-21;
- Thuốc: Ulsepan 40mg (Pantoprazole natrisesquihydrate 40mg), dạng bào chế: Viên nén bao tan trong ruột, số đăng ký: VN-22123-19;
* Lý do: Thu hồi theo quy định tại Điểm d, Khoản I Điều 58 Luật Dược và Khoản 5 Điều 42 Thông tư số 32/2018/TT-BYT.
3. Căn cứ công văn số 1926/SYT-NVYD của Sở Y tế Kiên Giang ngày 9 tháng 6 năm 2022 về việc thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam đối với 17 thuốc được cấp giấy đăng ký lưu hành.
- Thuốc: Trin Tablet (Cetirizin dihydroclorid 10mg), dạng bào chế: viên nén bao phim, số đăng ký: VN-20261-17;
- Thuốc: Carbaro200mg,tablets (Carbamazepin 200mg), dạng bào chế: viên nén, số đăng ký: VN-19895-16;
- Thuốc: Eurovir 200mg (Aciclovir vi tinh thể 200mg), dạng bào chế: viên nang cứng, số đăng ký: VN-19896-16;
- Thuốc: Stalevo-5 (Levocetirizin dihydrochlorid 5mg), dạng bào chế: viên nén bao phim, số đăng ký: VN-19897-16;
- Thuốc: Esoprazole-20 (Esomeprazol magnesidihydrat 20mg), dạng bào chế: viên nén bao tan trong ruột, số đăng ký: VN-20985-18;
- Thuốc: Ipadox Capsule (Doxycyclin hyclat 100mg), dạng bào chế: viên nang cứng, số đăng ký: VN-19892-16;
- Thuốc: Getoxatin-100mg/50ml (Oxaliplatin 2mg/1ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN3-119-19;
- Thuốc: Getoxatin-50mg/25ml (Oxaliplatin 2mg/1ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN3-228-19;
- Thuốc: Europlip 25mg (Amitriptylin HCl 25mg), dạng bào chế: viên nén bao phim, số đăng ký: VN-20472-17;
- Thuốc: Taxewell-20mg (Docetaxel trihydrate 20mg/0,5ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN-19893-16;
- Thuốc: Tipakwell-30mg/5ml (Paclitaxel USP 30mg/5ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN-19894-16;
- Thuốc: Xorunwell-L 20mg/10ml (Doxorubicin hydrochlorid 20mg/10ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN-20262-17;
- Thuốc: Xorunwell-L 10mg/5ml (Doxorubicin hydrochlorid 10mg/5ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN-20470-17;
- Thuốc: Xorunwell-L 50mg/25ml (Doxorubicin hydrochlorid 50mg/25ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN-20471-17;
- Thuốc: Tipakwell-260mg/43.4ml (Paclitaxel 260mg/43,4ml), dạng bào chế: dung dịch đậm đặc để pha dịch truyền, số đăng ký: VN2-544-17;
- Thuốc: Zedoxim Sachet (Cefpodoxim proxetil 40mg), dạng bào chế: bột pha hỗn dịch uống, số đăng ký: VN-21246-18;
- Thuốc: Incepcom (Mỗi nhát xịt chứa Fluticasone propionate 50mcg), dạng bào chế: hỗn dịch xịt mũi, số đăng ký: VN-20469-17;
Lý do: Thực hiện kiến nghị của Thanh tra Bộ Y tế tại Kết luận số 166/KL-TTrB của Thanh tra Bộ Y tế.
4. Căn cứ công văn số 2067/SYT-NVYD của Sở Y tế Kiên Giang ngày 21 tháng 6 năm 2022 về việc đình chỉ lưu hành, thu hồi mỹ phẩm không đạt tiêu chuẩn chất lượng.
Lô sản phẩm Dung dịch rửa tay kháng khuần HAPPICARE+; Lô sản xuất: H5-01.1511; Ngày sản xuất 15/11/2021; Hạn dùng: 15/11/2024; Trên nhãn ghi: SCB: 001722/20/CBMP-HCM, chịu trách nhiệm đưa sản phẩm ra thị trường: Công ty TNHH SX-TM thiết bị y tế HAPPICARE (Địa chỉ: 36/30/4 Bùi Tư Toàn, P. An Lạc, Q. Bình Tân, Tp. Hồ Chí Minh).
Lý do thu hồi: Mẫu thử không đáp ứng yêu cầu về giới hạn Methanol trong sản phẩm mỹ phẩm theo quy định của Hiệp định mỹ phẩm ASEAN và Thông tư 06/2011/TT-BYT ngày 25/01/2011 của Bộ Y tế.
5. Căn cứ công văn số 2068/SYT-NVYD của Sở Y tế Kiên Giang ngày 21 tháng 6 năm 2022 về việc đình chỉ lưu hành, thu hồi mỹ phẩm không đạt tiêu chuẩn chất lượng.
Lô sản phẩm Kem nghệ - E100; Lô sản xuất: 01; ngày sản xuất 02/8/19; Hạn dùng 05/2023; Trên nhãn ghi SĐK: 13/16/CBMP-BN, Công ty TNHH Tân Hà Lan - Halaco (Số 8, tổ 13, Tứ Liên, Tây Hồ, Hà Nội), Chi nhánh nhà máy: Lô F1, Cụm CN Đông Thọ, Yên Phong, Bắc Ninh).
Lý do thu hồi: Sản phẩm mỹ phẩm không đáp ứng yêu cầu chất lượng về giới hạn vi sinh vật trong mỹ phẩm (chỉ tiêu tổng số vi sinh vật đếm được) theo quy định tại Hiệp định mỹ phẩm ASEAN và Thông tư 06/2011/TT-BYT ngày 25/01/2011 của Bộ Y tế quy định về quản lý mỹ phẩm.
6. Căn cứ công văn số 2069/SYT-NVYD của Sở Y tế Kiên Giang ngày 21 tháng 6 năm 2022 về việc đình chỉ lưu hành, thu hồi mỹ phẩm không đạt tiêu chuẩn chất lượng.
Lô sản phẩm Dung dịch rửa tay khô Aerius – 19; Ngày sản xuất 10/02/2022; Hạn dùng 10/02/2025; Trên nhãn ghi SCB: 000175/16-CBMP-HCM, sản phẩm được Sở Y tế Tp. Hồ chí Minh công bố chất lượng số 001227/12/CBMP-HCM, sản xuất bởi: Công ty TNHH HMP Tiến Thịnh Phát (ĐC: 182/46 Huỳnh Tấn Phát, Nhà Bè, Tp. Hồ Chí Minh).
Lý do thu hồi: Mẫu thử không đáp ứng yêu cầu về giới hạn Methanol trong sản phẩm mỹ phẩm theo quy định của Hội đồng mỹ phẩm ASEAN và Thông tư 06/2011/TT-BYT ngày 25/01/2011.
|